卫材在日本提交仑卡奈单抗皮下制剂新药申请
东京2025年12月2日 /美通社/ -- 卫材与渤健共同宣布,卫材已就仑卡奈单抗全新给药途径皮下制剂(SC-AI)向日本药品医疗器械综合机构(PMDA)提交新药申请。
该申请是基于多项仑卡奈单抗皮下给药(SC)子研究的数据,这些子研究作为III期Clarity AD开放性延长研究(OLE)的一部分,针对因阿尔茨海默病(AD)导致的轻度认知障碍(MCI)患者或处于AD痴呆轻度阶段的患者(统称为早期AD)进行为期18个月的核心研究。经证实,每周一次使用500mg皮下自动注射器(SC - AI)给药,所产生的药物暴露量与每两周一次静脉(IV)给药相当,并且在临床和生物标志物方面带来的获益也相似。皮下给药的安全性特征与静脉给药相似,全身性注射/输注相关反应的发生率低于2%。
若获批,500mg剂量的皮下注射(SC-AI)(两支250mg注射剂量)可在治疗起始阶段用于居家每周一次给药,以替代当前在医院环境下每两周一次的静脉给药方式。SC-AI若获潜在批准,将为患者及其照护者增加居家接受仑卡奈单抗治疗的选项。每支自动注射器(250mg注射剂量)的注射时间约为15秒。此外,皮下注射剂型还有望减少与静脉给药相关的医疗资源占用,例如输液准备和护士监护等环节,同时简化阿尔茨海默病(AD)整体治疗护理流程。
仑卡奈单抗目前已在51个国家和地区获批上市,并在另外9个国家提交了上市申请。
仑卡奈单抗的全球开发和注册申请由卫材主导,而产品则由卫材和渤健共同商业化和推广。其中,卫材拥有最终决策权。
备注:本文是原文信息节选,详细报告内容详见 http://www.eisai.com/news/index.html。
免责声明
1、本新闻稿旨在传递科学前沿与医药领域相关信息,仅为对相关事件、动态及药品现状等进行客观呈现,不构成且在任何情形下均不应被视为对任何药物或治疗方案的推荐、诱导或推广。
2、本新闻稿中所含信息均截至发布日期,后续情况可能因各种因素发生变化。新闻稿中的所有行动和声明,均严格遵循并应遵守不时修订的适用法律法规。需明确的是,没有任何迹象表明与所述内容有关的所有信息均完整无遗地包含在本新闻稿中,可能存在信息不全面或未提及的情况。
3、本新闻稿包含部分前瞻性表述,这些表述基于管理层当前掌握的信息、设想及预测做出,涉及众多已知和未知的风险与不确定性。诸多因素可能导致实际结果与前瞻性表述中讨论的结果产生重大差异,这些因素包括但不限于经济形势变化、法律法规调整、产品研发进展、市场竞争态势、货币汇率波动等。卫材中国没有任何义务因新信息、未来事件或进展而对前瞻性声明进行更新。
4、对于因使用、依赖本新闻稿中包含的任何信息或任何信息遗漏而直接或间接产生的任何损失,无论是财产损失、利润损失还是其他类型的损失,卫材中国均不承担任何责任。若分发或使用其中的信息违反了适用的法律或法规,任何司法管辖区或国家的任何个人或实体均不得分发或使用这些信息。
-
 德达医疗:以专业之力,为HYROX赛事筑牢健康防线
德达医疗:以专业之力,为HYROX赛事筑牢健康防线 -
 黄浦江畔的设计诗篇:于上海前滩华尔道夫酒店,打造都市谧境
黄浦江畔的设计诗篇:于上海前滩华尔道夫酒店,打造都市谧境 -
 BORCHERS®亮相中国国际涂料展,以本地化创新与全球技术推动行业可持续发展
BORCHERS®亮相中国国际涂料展,以本地化创新与全球技术推动行业可持续发展 -
 新华丝路:上海闵行区着力打造特色咖啡产业
新华丝路:上海闵行区着力打造特色咖啡产业 -
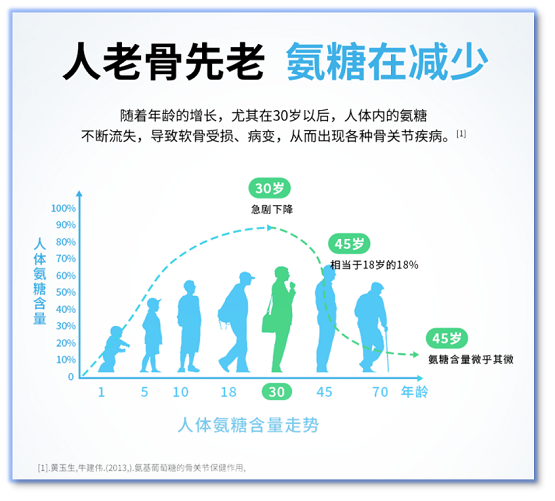
 荣膺AIIC2025年度酒业创新案例,振东五和养生酒以“药食同源”理念引领养生酒赛道突破!
荣膺AIIC2025年度酒业创新案例,振东五和养生酒以“药食同源”理念引领养生酒赛道突破! -
 广州千叶旗下AQUA爱克泳池设备落地山东:开启泳池新体验
广州千叶旗下AQUA爱克泳池设备落地山东:开启泳池新体验 -
 多行业案例:问卷网AI如何重塑调研新范式
多行业案例:问卷网AI如何重塑调研新范式 -
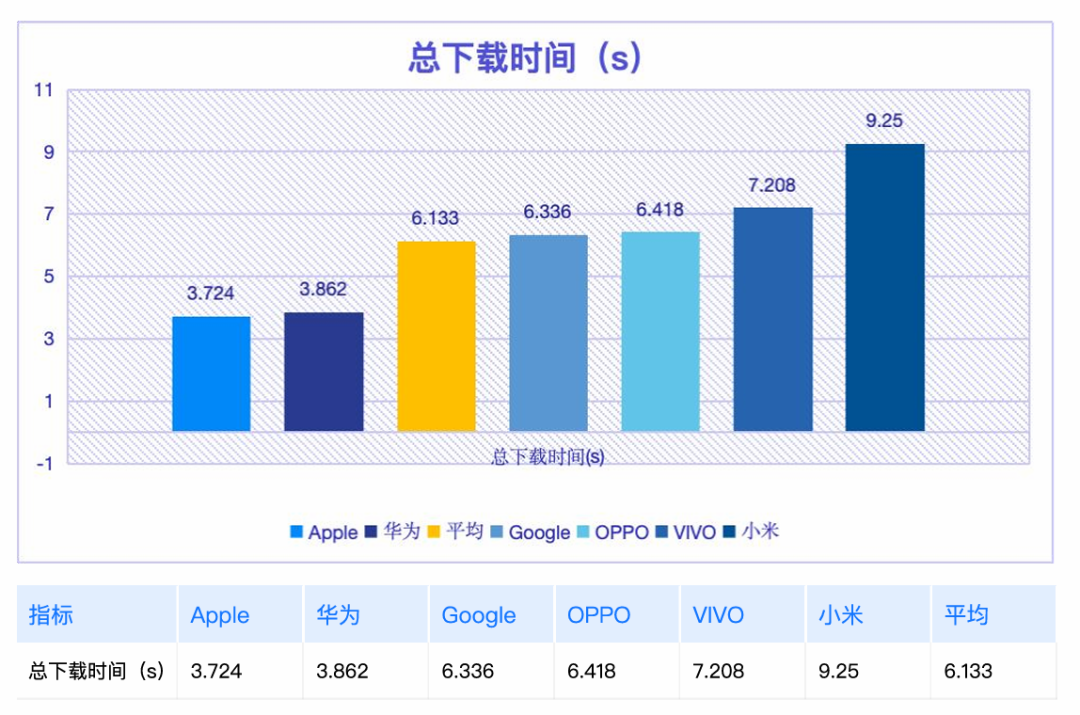
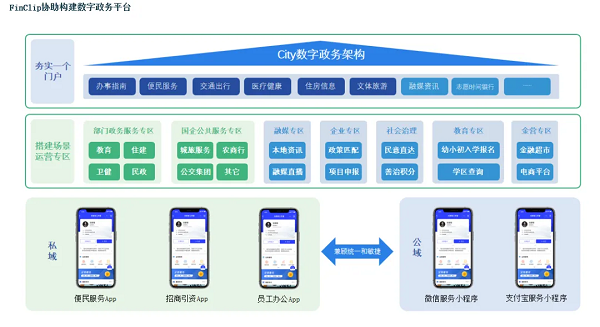 从“被动下载”到“主动爱用”:政务App如何真正成为便民好帮手?
从“被动下载”到“主动爱用”:政务App如何真正成为便民好帮手? -
 北京耀中耀华学子亮相联合国儿基会世界儿童日
北京耀中耀华学子亮相联合国儿基会世界儿童日 -
 国产铸造CAE——SupreCAST智铸超云3.0即将发布,引领中国工业秩序新生
国产铸造CAE——SupreCAST智铸超云3.0即将发布,引领中国工业秩序新生